SaMD – SOFTWARE as a MEDICAL DEVICE
`EM CONFORMIDADE COM ANVISA`
Paulo Rogério Rades, cpTICS
Nos últimos anos, vivenciamos uma crescente adoção de tecnologias da informação e comunicação no campo da saúde. Com isso, a Agência Nacional de Vigilância Sanitária (ANVISA) do Brasil tem se preocupado em regulamentar a utilização de tecnologias no setor, especialmente no que diz respeito a Software as a Medical Device (SaMD) ou Software como Dispositivo Médico, em português.
O SaMD pode ser definido como um software que tem a finalidade de ser utilizado para fins médicos, seja como ferramenta de diagnóstico, monitoramento de pacientes, tratamento ou prevenção de doenças. E, como qualquer dispositivo médico, é necessário que esses softwares sejam regulamentados pela ANVISA para garantir sua segurança e eficácia.
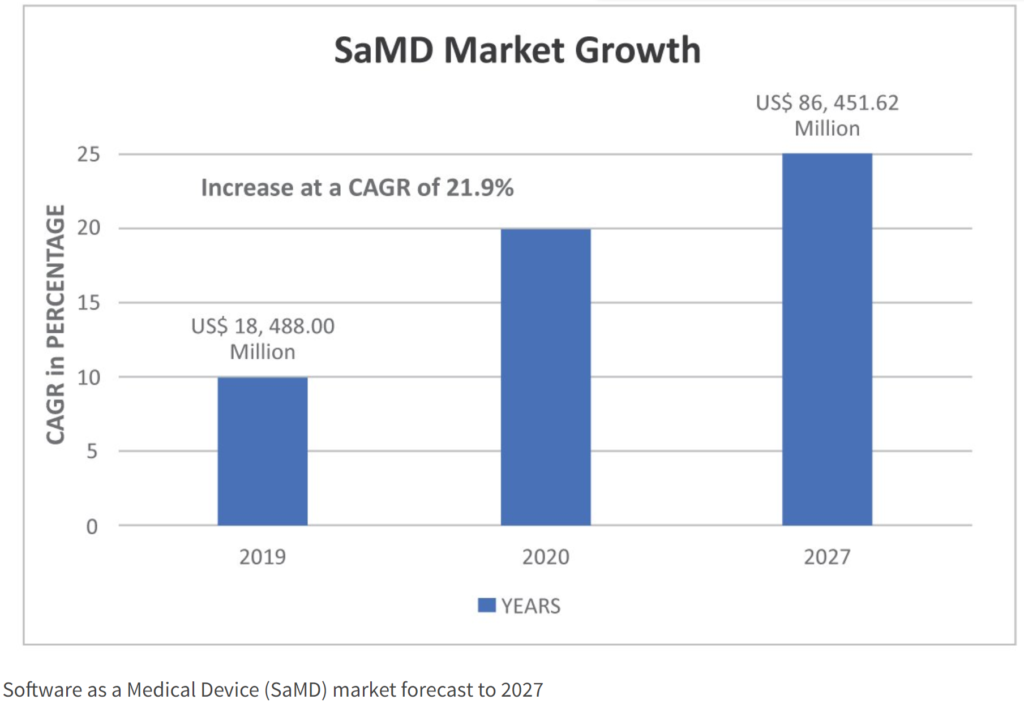
Fonte: MedTech Innovation
A ANVISA estabeleceu uma série de normas e regulamentações para o uso de SaMD, que variam de acordo com o risco do dispositivo. Os softwares de maior risco passam por um processo mais rigoroso de análise e testes para receber a autorização de uso.
Os requisitos estabelecidos pela ANVISA para os SaMD incluem:
-
- Classificação de risco: A Anvisa classifica os SaMD em quatro níveis de risco, de acordo com a probabilidade de causar danos ao paciente.
-
- Regulação: A Anvisa exige que os SaMD sejam registrados e regulados pela agência antes de serem comercializados no país.
-
- Testes clínicos: A Anvisa exige que os SaMD passem por testes clínicos para garantir sua segurança e eficácia.
-
- Vigilância pós-comercialização: A Anvisa também exige que os fabricantes de SaMD monitorem continuamente seus dispositivos e relatem quaisquer eventos adversos ou falhas.
-
- Atualização do software: A Anvisa também exige que os fabricantes de SaMD estabeleçam um plano de atualização do software para garantir que o dispositivo esteja sempre atualizado e seguro.
A regulamentação de SaMD é essencial para garantir a segurança e eficácia desses dispositivos no campo da saúde. Os dispositivos médicos digitais têm um grande potencial para melhorar a qualidade do atendimento e reduzir os custos de saúde. No entanto, é importante que a Anvisa continue a acompanhar e atualizar suas regulamentações para acompanhar o rápido avanço da tecnologia médica.
Quais as categorias de Software as a Medical Devices segundo a ANVISA?

De acordo com a Anvisa, o Software as a Medical Devices (SaMD) são classificados em quatro categorias de risco, de acordo com sua finalidade e probabilidade de causar danos ao paciente. São elas:
-
- Classe I: SaMDs de baixo risco, que são aqueles que têm baixo potencial de causar danos ao paciente e cuja utilização pode ser facilmente controlada por meio de medidas de precaução simples. Exemplos incluem softwares de gestão de prontuário eletrônico, softwares de agendamento de consultas e softwares de gerenciamento de dados de pacientes.
-
- Classe IIa: SaMDs de risco moderado, que são aqueles que apresentam um risco moderado ao paciente, mas que podem ser controlados por meio de medidas de precaução razoáveis. Exemplos incluem softwares de suporte a decisões clínicas, softwares de monitoramento de sinais vitais e softwares de diagnóstico auxiliar.
-
- Classe IIb: SaMDs de alto risco, que apresentam um risco significativo ao paciente e exigem medidas de precaução especiais para garantir sua segurança. Exemplos incluem softwares para monitoramento e controle de dispositivos médicos implantáveis, softwares para diagnóstico de câncer e softwares para análise de imagem médica.
-
- Classe III: SaMDs de alto risco e/ou de uso crítico, que apresentam um risco extremamente elevado ao paciente e podem ser utilizados em procedimentos cirúrgicos e terapias complexas. Exemplos incluem softwares para planejamento cirúrgico e softwares para controle de sistemas de radioterapia.
É importante ressaltar que a classificação de um SaMD pode mudar conforme novas informações são obtidas a respeito de sua segurança e eficácia, e que a ANVISA pode exigir estudos adicionais para a sua aprovação e comercialização.
Em resumo, a ANVISA do Brasil estabeleceu uma série de requisitos para regulamentar o uso de SaMD, garantindo que esses dispositivos sejam seguros e eficazes no campo da saúde. Os fabricantes de SaMD devem seguir essas regulamentações para garantir que seus produtos possam ser comercializados e utilizados no país. A regulamentação é um passo importante para garantir que a tecnologia médica continue avançando de forma segura e eficaz.
SOBRE NÓS:
A InterOpera é uma empresa que atua sobre as complexas nuances da interoperabilidade entre sistemas e dispositivos médicos com know-how para atender as suas necessidades.
Acompanhe nossa série de artigos no Linkedin.
Entre em contato para mais informações.








